Las enzimas son proteínas complejas que producen un cambio químico específico en otras sustancias, sin que exista un cambio en ellas mismas. Por ejemplo, las enzimas pueden convertir los almidones, las proteínas y los azúcares en sustancias que el cuerpo pueda utilizar. La coagulación de la sangre es otro ejemplo del trabajo de las enzimas.
[Tomado de: http://www.biologia.arizona.edu/biochemistry/problem_sets/energy_enzymes_catalysis/graphics/q1ta.gif]
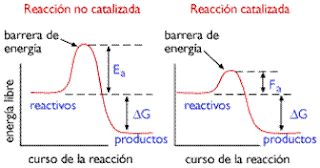
Las enzimas son catalizadores biológicos. Los catalizadores rebajan la energía de activación de las reacciones. La rebaja de la energía de activación de una reacción, hace que la velocidad de la reacción aumente. Asi, las enzimas aceleran las reacciones, rebajando la energía de activación. Muchas enzimas cambian de forma cuando sus sustratos se unen a ellas. Este efecto se llama "acoplamiento inducido", significando que se requiere la orientación y colocación precisa de la enzima para que su actividad catalítica sea inducida por la unión del sustrato.
La característica más sobresaliente de los enzimas es su elevada especificidad. Esta es doble y explica que no se formen subproductos:
1. Especificidad de sustrato. El sustrato (S) es la molécula sobre la que el enzima ejerce su acción catalítica.
2. Especificidad de acción. Cada reacción está catalizada por un enzima específico.
La acción enzimática se caracteriza por la formación de un complejo que representa el estado de transición.
E + S --> ES --> E + P
El sustrato se une al enzima a través de numerosas interacciones débiles como son: puentes de hidrógeno, electrostáticas, hidrófobas, etc, en un lugar específico , el centro activo. Este centro es una pequeña porción del enzima, constituído por una serie de aminoácidos que interaccionan con el sustrato.
Algunas enzimas actúan con la ayuda de estructuras no proteícas. En función de su naturaleza se denominan:
1. Cofactor. Cuando se trata de iones o moléculas inorgánicas.
2. Coenzima. Cuando es una molécula orgánica. Aquí se puede señalar, que muchas vitaminas funcionan como coenzimas; y realmente las deficiencias producidas por la falta de vitaminas responde más bien a que no se puede sintetizar un determinado enzima en el que la vitamina es el coenzima.
Mecanismos de acción
CLASIFICACIÓN Y NOMENCLATURA
El nombre de una enzima suele derivarse del sustrato o de la reacción química que cataliza, con la palabra terminada en -asa.
La Unión Internacional de Bioquímica y Biología Molecular ha desarrollado una nomenclatura para identificar a las enzimas basada en los denominados Números EC. De este modo, cada enzima queda registrada por una secuencia de cuatro números precedidos por las letras "EC". El primer número clasifica a la enzima en base a su mecanismo de acción. A continuación se indican las seis grandes clases de enzimas existentes en la actualidad:
· EC1 Oxidorreductasas: Catalizan reacciones de oxidorreducción o redox. Precisan la colaboración de las coenzimas de oxidorreducción (NAD+, NADP+, FAD) que aceptan o ceden los electrones correspondientes.
· EC2 Transferasas: Transfieren grupos activos (obtenidos de la ruptura de ciertas moléculas) a otras sustancias receptoras.
· EC3 Hidrolasas: Catalizan reacciones de hidrólisis con la consiguiente obtención de monómeros a partir de polímeros.
· EC4 Liasas: Catalizan reacciones en las que se eliminan grupos H2O, CO2 y NH3 para formar un doble enlace o añadirse a un doble enlace.
· EC5 Isomerasas: Actúan sobre determinadas moléculas obteniendo de ellas sus isómeros funcionales o de posición.
· EC6 Ligasas: Catalizan la degradación o síntesis de los enlaces denominados "fuertes" mediante al acoplamiento a moléculas de alto valor energético como el ATP.
Referencia bibliográfica de redes académicas:
- · University of Maryland. Medical Center. Enzima – Informacion general. [En línea:] http://www.umm.edu/esp_ency/article/002353.htm [Citado: 3 de octubre de 2010]
- · El proyecto biológico. Bioquímica. Problemas de energía, enzimas y catálisis. [En línea:] http://www.biologia.arizona.edu/biochemistry/problem_sets/energy_enzymes_catalysis/01t.html [Citado: 3 de octubre de 2010]
- · Enzimas. Características de la acción enzimática. [En línea:] http://www.lourdes-luengo.org/unidadesbio/proteinas/enzimas.htm [Citado: 3 de octubre de 2010]
- · Wikipedia. Enzima. Clasificación y nomenclatura. [En línea:] http://es.wikipedia.org/wiki/Enzima#Clasificaci.C3.B3n_y_nomenclatura_de_enzimas [Citado: 3 de octubre de 2010]

No hay comentarios:
Publicar un comentario